Будучи известной еще древним египтянам, сера играла большую роль в теоретических представлениях алхимиков, так как считалась наиболее совершенным выразителем одного из «основных начал» природы – горючести. По содержанию в земной коре (0,03%) она относится к весьма распространенным элементам.
Формы нахождения серы в природе разнообразны. Иногда она встречается в самородном состоянии, но основная ее масса связана с металлами в составе различных минералов, которые могут быть разбиты на две большие группы: сернистых и сернокислых соединений. Изминералов первого типа особое значение для технологии серы имеет пирит (FeS2 ). Кминералам второго типа относится, например, гипс (CaSO4 . 2Н2 О). Кроме того, соединениясеры обычно присутствуют в вулканических газах и воде некоторых минеральных источников.Сера входит также в состав белковых веществ и поэтому всегда содержится в организмахживотных и растений.
Мировое потребление серы составляет около 4 млн. т ежегодно. Довольно значительная часть этого количества расходуется для борьбы с вредителями сельского хозяйства. Промышленными потребителями серы являются производства: сернокислотное, бумажное, резиновое, спичечное и др. Сера широко используется также в пиротехнике «и отчасти в медицине.
Свободная сера может быть получена либо из ее самородных месторождений, либо из соединений.
Почти вся миро вая выработка осуществляется по первому варианту, причем технологический процесс сводится к отделению серы от смешанных с нею пород (песка, глины и т. п.). Это достигается обычно путем плавления серы в результате обработки руды нагретым до 140–150°С водяным паром.
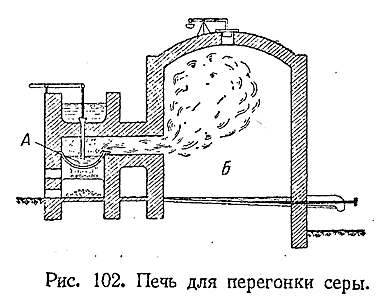
Получаемая из природных месторождений сера почти всегда родержит примеси. Для очистки ее подвергают перегонке в специальныхпечах (рис. 102). Пар серы, нагреваемый в чаше А, попадая в камеру Б, быстро охлаждается и сера оседает на стенках в виде мельчайших пылинок («серного цвета»). Если камера Б нагрета выше 120 °С, то получается жидкая сера, которая затем нацело затвердевает. Такая сплавленная сера обычно и поступает в продажу.
Чистая сера представляет собой желтое кристаллическое вещество с плотностью около 2, плавящееся при 119°С и кипящее при 445°С. Она очень плохо проводит тепло и электричество. В воде сера нерастворима. Лучшим ее растворителем является сероуглерод (CS2 ).
1) Для твердой элементарной серы типичны две аллотропические формы. Ниже 95,6 °С устойчива обычная желтая сера с плотностью 2,07, имеющая т. пл. 112,8 °С (при быстром нагревании). Напротив, выше 95,6 °С устойчива почти бесцветная модификация с плотностью 1,96 и т. пл. 119,3°С. Различие обеих форм обусловлено их разной кристаллической структурой.
2) Плавление серы сопровождается заметным увеличением ее объема (примерно на 15%). Расплавленная сера представляет собой желтую, легкоподвижную жидкость, которая выше 160 °С буреет и при 190 °С превращается в темно–коричневую вязкую массу. Выше 190 °С вязкость ее начинает уменьшаться и около 400°С расплавленная сера, оставаясь темно–коричневой, вновь становится легкоподвижной.
Эти переходы свойств при нагревании обусловлены изменением внутреннего строения серы. Для нее при обычных условиях характерны восьмиатомныекольцевые молекулы (рис. 103). Выше 160 °С кольца S8 начинают разрываться, переходя в открытые цепи, что сопровождается повышением вязкости (и изменением цвета). Дальнейшее нагревание выше 190 °С ведет к уменьшению средней длины подобных цепей, вследствие чего вязкость вновь понижается.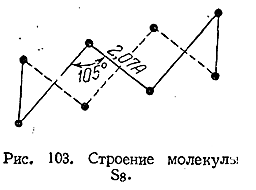
3) Чистая сера не ядовита. Прием внутрь небольших ее количеств способствует рассасыванию нарывов и полезен, в частности, при геморрое. Организм человека не обнаруживает привыкания к сере. Очень мелко раздробленная (осажденная) сера входит в состав ряда мазей, предназначаемых для ухода за кожей и лечения кожных заболеваний.
На холоду сера довольно инертна (энергично соединяется только с фтором), но при нагревании становится весьма химически активной – реагирует с галоидами (кроме иода), кислородом, водородом и почти со всеми металлами. В результате реакций последнего типа образуются соответствующие сернистые соединения, например, по уравнению:
Fe + S = >FeS + 23 ккал
С водородом сера в обычных условиях не соединяется. Лишь при нагревании имеет место обратимая реакция
Н2 +S = > H2 S + 5 ккал
равновесие которой около 350 °С смещено вправо, а при дальнейшем повышении температуры смещается влево. Практическисероводород (H2 S) получают обычно действием разбавленных кислот на сернистые металлы по реакции, например:
FeS + 2HCl = >FeCl2 + H2 S
4) Удобный способ добывания H2 S состоит в нагревании приблизительно до 300 °С смеси серы с парафином (2:1 по весу) и измельченным асбестом. При охлаждении реакция прекращается, но может быть вновь вызвана нагреванием.
Сероводород представляет собой бесцветный газ (т. пл. –86 СС, т. кип. –60 °С). Уже 1 ч. H2 S на 100 000 ч. воздуха обнаруживается по его характерному запаху (тухлых яиц). Сероводород
весьма ядовит. Будучи подожжен на воздухе, он сгорает по одному из следующих уравнений:
2H2 S+ ЗО2 = 2H2 О + 2SO2 (при избытке кислорода)
2H2 S + O2 = 2H2 O + 2S (при недостатке кислорода)
Один объем воды растворяет при обычных условиях около 3 объемов сероводорода (с образованием приблизительно 0,1 М раствора). При стоянии на воздухе водный раствор H2 S («сероводородная вода») постепенно мутнеет вследствие выделения серы по второй из приведенных выше реакций. Иод легко восстанавливается сероводородом по уравнению:
J8 + H2 S = 2HJ+S
Аналогично действует сероводород и на многие другие вещества. Он является, таким образом, сильным восстановителем. В водномрастворе H2 S ведет себя как весьма слабая кислота. Средние соли этой сероводородной кислоты (с анионом S2-) называются сернистыми или сульфидами, кислые соли (с анионом HS–) – кислыми сернистыми или гидросульфидами. Несмотря на бесцветность самих ионов S" и HS', многие соли сероводородной кислоты окрашены в характерные цвета. Подавляющее большинство сульфидов (за исключением производных Na, К и немногих других катионов) очень труднорастворимо в воде. Напротив, большая часть гидросульфидовхорошо растворима (и известна лишь в растворе).
5) Сероводородная кислота (К1 = 9·10–8 и К2 = 4·10–13) несколько слабее угольной. Помимо прямого соединения металла с серой иреакции нейтрализации, многие ее соли могут быть получены обменным разложением солей соответствующего металла с H2 S или (NH4 )2 S. Часто применяемый в лабораториях раствор последней соли готовят обычно, насыщая сероводородом раствор NH4 OH (что дает NH4 SH) и смешивая его затем с равным объемом NH4 OH.
6) На различной растворимости сернистых соединений отдельных металлов основан обычный систематический ход качественного анализа катионов. Одни из них (Na·, К·, Ва·· и др.) образуют сульфиды, растворимые в воде, другие (Fe ·\ Mn', Zn" и др.)–не растворимые в воде, но растворяющиеся в разбавленной НСl, наконец, третьи (Cu··, Pb·· H··и др.)–не растворимые ни в воде, ни в разбавленныхкислотах. Поэтому, действуя на раствор смеси катионов сероводородом сначала в кислой среде, затем в слабощелочной, можно отделить рассматриваемые группы катионов друг от друга и дальше вести анализ уже в пределах каждой из них отдельно.
7) При внесении в крепкий раствор сульфида мелко растертой серы она растворяется с образованием соответствующего полисульфида(многосернистого соединения), например: (NH4 )2 S +( x– 1)S = (NH4 )2 Sx . Обычно образуется смесь полисульфидов с различным содержанием серы. По мере увеличения х цвет соединения меняется от желтого через оранжевый к красному. Интенсивно красную окраску имеет и самое богатое серой соединение этого типа– (NH4 )2 S9 . Из встречающихся в природе полисульфидов наиболее известен минерал пирит (FeS2 ), представляющий собой железную соль двусернистого водорода.
8) Если крепкий раствор полисульфида вылить в избыток раствора НСl, на дне сосуда собирается тяжелое масло, представляющее собой смесь многосернистых водородов общей формулы H2 Sx . В индивидуальном состоянии были выделены все члены ряда вплоть до Н2 S6 . Они представляют собой очень неустойчивые маслянистые желтые жидкости с резким запахом.
Сродство серы к галоидам по ряду F–Сl–Вr–J настолько быстро уменьшается, что ее йодистое производное получить вообще не удается. С остальными галоидами она более или менее легко соединяется. Из образующихся соединений наиболее интересна газообразная при обычных условиях шестифтористая сера (SF6 ). Она бесцветна, не имеет запаха и не ядовита. От других галоге–нидовсеры SF6 отличается своей исключительной химической инертностью. Как газообразный изолятор, она находит применение в высоковольтных установках. Жидкая при обычных условиях хлористая сера (S2 CI2 ) используется в резиновой промышленности.
9) Некоторые свойства галоидных соединений серы сопоставлены ниже:

Большинство этих соединений образуется при непосредственном взаимодействии элементов и легко разлагается водой.
Заметное взаимодействие серы с кислородом наступает лишь при нагревании. Будучи подожжена на воздухе, она сгорает синим пламенем с образованием двуокиси по реакции:
S + O2 = SO2 + 71 ккал
Молекула O = S = O полярна (длина диполя 0,33 А). Атомы ее располагаются в углах равнобедренного треугольника с S при вершине [d(SO) = 1,43 А, а (альфа) = 120°]. Двуокись серы (иначе, сернистый газ) представляет собой бесцветный газ с характерным резким запахом (т. пл, –73°С, т. кип. –10°С). Растворимость его составляет при обычных условиях около 40 объемов на 1 объем воды.





























