Все процессы неорганической химии можно разбить на два типа: а) идущие без изменениявалентности реагирующих элементов и б) идущие с изменением валентности. К первому из них относятся различные случаи обменного разложения, уравнения которых обычно весьма просты. Ко второму типу относятся реакции вытеснения и ряд иных, часто очень сложных химических процессов. Для быстрого и правильного составления их уравнений необходимо овладеть специально разработанной методикой.
Реакции второго типа называются окислительно–восстановительными или, сокращенно (но не вполне точно), реакциями окисления. Первоначально под окислением понималось только присоединение к веществу кислорода, под восстановлением – его отнятие. Понятия «окисление» и «восстановление» можно, однако, обобщить, если принять во внимание, чтокислород почти всегда оттягивает к себе электроны от соединяющегося с ним элемента. Вследствие этого сущность окисления состоит в потере электронов окисляющимся веществом. Наоборот, при восстановлении оно получает обратно отданные ранее электроны., Следовательно, сущность восстановления состоит в присоединении электроноввосстанавливающимся веществом.
Для дальнейших рассуждений несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная связь). Поэтому при разборе материала данного параграфа мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, следовательно, окислительно–восстановительные реакции можно определить как процессы, связанные с переходом электронов от одних атомов к другим.
Рассмотрим ряд соединений хлора:
НСl Сl2 Сl2 О Сl2 О7
В НСl хлор отрицательно одновалентен. В молекуле Сl2 ни один , из атомов не оттягиваетэлектронов больше другого; следовательно, заряд каждого из них равен нулю. В Сl2 О хлорснова одновалентен, но уже положительно. В Cl2 O7 хлор положительно семивалентен. Схематически все это можно обозначить так:
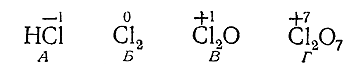
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г – шестьэлектронов, от Б к Г – семь электронов. Наоборот, при переходе от Г к В каждый хлор присоединяет шесть электронов, от Г к Б – семьэлектронов, от Г к А – восемь электронов. Вещество, в состав которого входит элемент, присоединяющий электроны, называетсяокислителем; вещество, содержащее элемент, отдающий электроны– восстановителем.
1) Соотношение между понятиями «восстановитель» и «окислитель» может быть наглядно выражено схемой: восстановитель <=>электроны <=> окислитель. Простейшей окислительно–восстановительной системой является установка для электролиза (рис. 101). В ней катод отдает ионам электроны, т. е является восстановителем, а анод их с ионов снимает, т. е. функционирует как окислитель. Следует отметить, что из всех имеющихся в распоряжении химии окислительно–восстановительных методов электролиз является самым мощным и универсальным.
2) При работах с окислителями и восстановителями удобно пользоваться их нормальными концентрациями. Под нормальнымраствором окислителя или восстановителя понимают раствор, содержащий в литре один окислительный эквивалент, т. е. часть грамм–молекулы, отвечающую одному присоединяемому или отдаваемому каждой молекулой электрону. Например, при применении в качестве окислителя НСlO3, восстанавливающейся до НСl, валентность хлора изменяется от +5 до –1, т. е. один его атом (а следовательно, и одна молекула НСlO3 ) присоединяет 6 электронов.
Поэтому нормальный раствор НClO3, как окислителя, будет содержать в литре 1/6 грамм–молекулы (а как кислоты – одну грамм–молекулу). Все обозначения концентраций остаются такими же, как и при нормальных растворах кислот и оснований (V § 5).
Для составления уравнения окислительно–восстановительной реакции прежде всего необходимо знать химические формулы вводимых в нее веществ и получающихся продуктов. Первые мы, естественно, знаем, вторые же должны быть установлены либо специальным химическим исследованием, либо прямо на основании известных свойств элементов. Так как, однако, окислительно–восстановительные процессы протекают обычно в водных растворах, непосредственно определить, входит ли вода в реакцию или, наоборот, получается в ее результате, часто бывает невозможно, и это выясняется лишь в процессе составления уравнения.
Простейшим примером окислительно–восстановительного процесса может служить любая реакция вытеснения (V § 8). Ниже рассматривается несколько более сложная реакция взаимодействия раствора хлорноватой кислоты с элементарным фосфором.
Исследование продуктов этой реакции показывает, что в результате взаимодействия образуются Н3РО4 и НСl. Следовательно:
НСlО3 + Р => Н3 РО4 + НСl (I)
Найдя заряды меняющих валентность элементов и надписав их над последними, имеем:
HCl+5O3 + P0 => H3P+5O4 + HCl–1 (II)
Из уравнения (II) видно, что валентность хлора изменилась от + 5 до –1. Следовательно, НСlO3 является окислителеми одна еемолекула (точнее, хлор) в процессе реакции присоединяет шесть электронов. С другой стороны, валентность фосфора изменилась от 0 до +5. Следовательно, фосфор является восстановителем и каждый его атом отдает пять электронов. Отмечая это под соответствующими веществами, имеем:
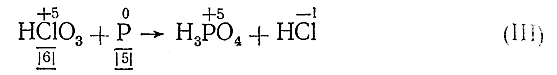
Но все молекулы веществ и уступающих в реакцию и получающихся электронейтральны. Поэтому общее число электронов, отданных в процессе реакции восстановителем, должно быть равно общему числу электронов, присоединенных окислителем. Отсюда находим основные коэффициенты уравнения – коэффициенты при окислителе и восстановителе:
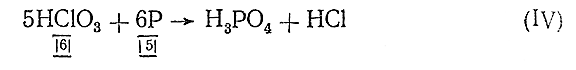
Теперь проверяем число атомов каждого элемента в обеих частях уравнения и расставляем соответствующие коэффициенты (начинать проверку целесообразно с элементов, изменяющих в процессе реакции свою валентность; водород и особенно кислород, если они не входят в уравнение в свободном состоянии, следует обычно проверять последними). Уравняв при помощи коэффициентов число атомов Сl и Р в обеих частях, приходим к следующему выражению:
5НСlО3 + 6Р = 6Н3 РО4 + 5НСl (V)
Проверяя водород, видим, что в правой части уравнения его значительно больше, чем в левой. Так как свободный водород в систему не вводился, это значит, что в реакции участвовала вода. Поэтому окончательно имеем:
5НСlО3 + 6Р + 9Н2 О = 6Н3РО4 + 5НСl (VI)
Проверяя кислород, убеждаемся в том, что уравнение составлено правильно.
Формулируя вкратце разобранное выше, приходим к следующей логической последовательности мысленных операций при составлении уравнений окислительно–восстановительных реакций (попутно в качестве более сложного примера рассмотрено взаимодействие между As2 S3 и HNO3 ):
I. Устанавливаем формулы веществ, получающихся в результате реакции:
As2 S3 + HNO3 = H3 AsO4 + H2 SO4 + NO
II. Определяем валентность элементов, изменяющих ее в процессе реакции, до и после нее:
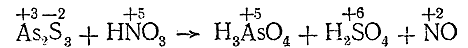
III. Подсчитываем число электронов, отдаваемое молекулой восстановителя и присоединяемое молекулой окислителя:
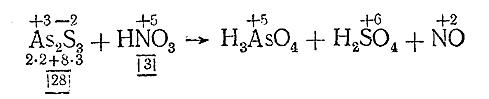
IV. Находим основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
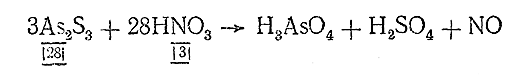
V. Проверяем число атомов каждого элемента (пока без водорода и кислорода) в начальных и конечных продуктах реакции и уравниваем его, расставляя коэффициенты:
3As2 S3 + 28HNO3 = 6H3 AsO4 + 9H2 SO4 + 28NO
VI. Проверяем водород и находим число молекул воды, участвующей в реакции:
3As2 S3 + 28HNO8 + 4Н2 О = 6H8 As04 + 9H2 SO4 + 28NO
VII. Проверяем кислород и убеждаемся в том, что уравнение составлено правильно.
Само собой разумеется, что нет надобности переписывать реакцию несколько раз, и все указанные выше операции производятся последовательно с одним и тем же уравнением (при некотором навыке– в уме). Признаком правильности расставленных коэффициентов является равенство числа атомов каждого элемента в обеих частях уравнения.
Упражнения. Закончить следующие схематические уравнения:
1) Sb2 S5 + HNO3 = H3 Sb04 + H2 SO4 + NO
2) FeSO4 + KClO3 + H2 SO4 = Fe(SO4)3 + KCl
3) HOCl + Br2 = НВrО3 + HCl
4) НСlO3 + HCl = >Cl2





























