Содержание селена в земной коре составляет 1·10–50 %, теллура – 1 ·10–7%, а полония – лишь 2 ·10–15%. Последний относится к наименее распространенным в природе элементам. Он радиоактивен и с химической стороны почти не изучен.
Для селена и теллура наиболее характерно совместное нахождение с такими металлами, как Pb, Cu, Hg, Ag и Au. Однако самостоятельно минералы Se и Те встречаются крайне редко, обычно же лишь в виде примесей к аналогичным минералам серы.
Основными источниками получения селена и теллура служат отходы сернокислотного производства (пыль каналов и пылевых камер, ил промывных башен) и осадки («шламы»), образующиеся при очистке меди электролизом. Ежегодная мировая выработка селенаисчисляется сотнями, теллура – десятками тонн.
1) Извлечение Se и Те из производственных отходов основано на переводе обоих элементов в четырехвалентное состояние с последующим их восстановлением сернистым газом.Восстановление первоначально ведется в 10–12 н соляной кислоте, причем выделяется толькоселен. Затем, после сильного разбавления жидкости водой, выделяется теллур.
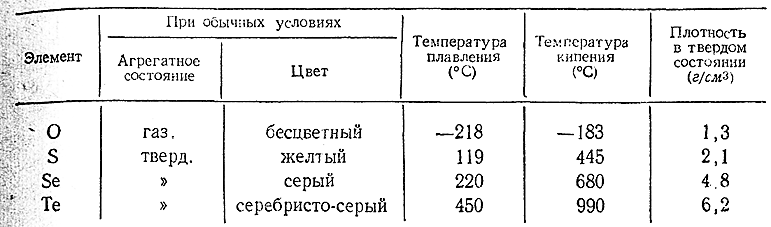
При выделении из растворов своих соединений селен и теллур осаждаются в виде порошков, соответственно красного и коричневого цвета (т. н. аморфные Se и Те). Однако наиболее типичны для них кристаллические модификации, некоторые свойства которых сопоставлены ниже со свойствами кислорода исеры. Оба элемента устойчивы на воздухе и нерастворимы вводе. Все соединения селена ядовиты.
2) Для селена и теллура известно несколько аллотропических модификаций, которые, однако, еще сравнительно мало изучены. Селенпотребляется главным образом при изготовлении выпрямителей переменного тока, а теллур в производстве свинцовых кабелей.Добавка его (до 0,1%) к свинцу сильно повышает твердость и эластичность последнего Такой свинец оказывается также более стойким по отношению, к различным химическим воздействиям.
С химической стороны селен и теллур в общем весьма похожи на серу. Из металлоидов они наиболее энергично взаимодействуют сфтором и хлором, а с кислородом (как и сера) соединяются лишь после предварительного нагревания. С газообразным водородомчастично реагирует при повышен ных температурах только селен, тогда как теллур с ним непосредственно не соединяется. Со многимиметаллами Se и Те дают при нагревании аналогичные сульфидам селениды и теллурриды (например, K2 Se, K2 Te).
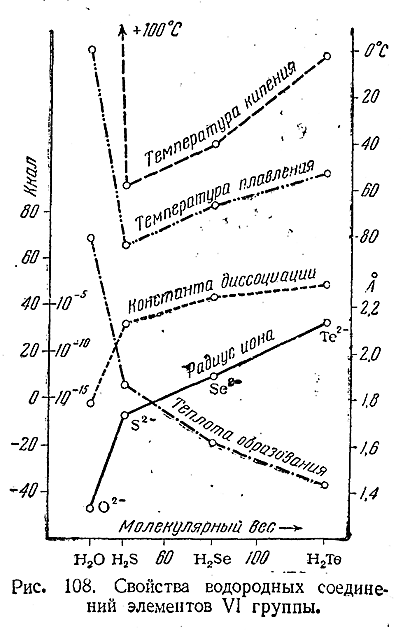
При действии на них разбавленных кислот образуются селено–водород (H2 Se) и теллуроводород (Н2 Те). Оба они представляют собой бесцветные газы с характерными неприятными запахами. Растворимость их в воде примерно такая же, как у сероводорода, причемрастворы показывают ясно выраженную кислую реакцию. Некоторые важнейшие свойства рассматриваемых соединений сопоставлены в приводимой таблице и на рис. 108 с аналогичными свойствами Н2 О и H2 S. Для приблизительной ориентировки в размерах соответствующих молекул приведены также радиусы ионов Э2–.

Из данных таблицы видно, что H2 Se и Н2 Те являются кислотами более сильными, чем уксусная (К = 2· 10–5). Оба соединения (особенно Н2 Те) весьма неустойчивы и легко разлагаются. Кислородом воздуха они постепенно окисляются и в газообразном состоянии и особенно в растворе уже при обычных температурах. В общем восстановительные свойства характерны для H2 Se и Н2 Те еще более, чем для сероводорода.
3) Все галоидные соединения селена и теллура могут быть получены путем взаимодействия элементов. Известны следующиегалогениды:

По своему характеру галогениды селена похожи на соответствующие производные серы, причем тип Э2 Г2 в данном случае менее, а тип ЭГ4 – более устойчив.





























