Содержание элементов рассматриваемой подгруппы в земной коре сравнительно невелико и по ряду мышьяк (1·10–4 %) – сурьма (5·10–6 %) – висмут (2·10–6%) уменьшается. Встречаются они главным образом в виде сернистых минералов – реальгарa (As4 S4 ), аурипигмента (As2 S3 ), сурьмяного блеска (Sb2 S3 ) и висмутового блеска (Bi2 S3 ). Все три элемента часто содержатся также в виде примесей к рудам различных металлов, при добыче которых они могут быть выделены как побочные продукты.
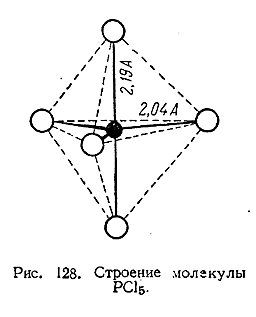
Для получения As, Sb и Bi из их сернистых руд последние накаливают на воздухе, причемсульфиды переходят в окислы, которые затем восстанавливают углем. Реакции идут по схемам:
232 S3 + 9O2 = 6SO2 + 2Э2 O3
Э2 O3 + ЗС = ЗСО + 2Э
В свободном состоянии элементы подгруппы мышьяка имеют металлический вид и довольно хорошо проводят тепло и электричество. Однако они очень хрупки и легко могут быть измельчены в порошок. Важнейшие их– константы(наряду с соответствующими данными для азота и фосфора) сопоставлены ниже:
На воздухе при обычных условиях Sb не изменяется, a As и Bi слегка окисляются с поверхности. Ни в воде, ни в органическихрастворителях мышьяк и его аналоги нерастворимы. Со многими металлами они легко даюг сплавы.
1) Подобно фосфору, мышьяк способен существовать в нескольких аллотропических формах, из которых обычная серая является наиболее устойчивой. При очень быстром охлаждении паров As получается желтый мышьяк уд. веса 2,0, а при возгонке As в струеводорода образуется аморфный черный мышьяк с плотностью 4,7. Сурьма в отношении аллотропии весьма похожа на мышьяк, а длявисмута при обычных условиях известна только одна форма.
2) Мышьяк используется главным образом для добавки (порядка 0,5%) к свинцу при выработке дроби. Добавка эта повышает твердостьметалла и сообщает ему способность застывать в виде капель строго шарообразной формы.
Соединения мышьяка применяются в медицине, при выделке кож и мехов, в производствах стекольном, фарфоровом и др. Важнейшей областью их использования является, однако, сельское хозяйство, где различные производные As служат средством борьбы с вредителями культурных растений. Ежегодная мировая добыча As составляет около 50 тыс. т.
Сурьма является важной составной частью некоторых ответственных сплавов (типографский шрифт, сплавы для подшипников и др.). Соединения ее используются в промышленности резиновой, стекольной, красильной, спичечной и др. Ежегодная мировая добыча Sb составляет около 50 тыс. г.
Висмут служит главным образом для изготовления различных сплазов, которым он обычно сообщает легкоплавкость. Сплавы эти важны для противопожарной арматуры, сигнальных аппаратов и т. д. Соединения Bi применяются главным образом в медицине, косметике и в стекольной промышленности. Ежегодная мировая добыча Bi составляет около 2 тыс. т.
В ряду напряжений As, Sb и Bi располагаются между водородом и медью. Поэтому водорода из кислот они не вытесняют, но могут быть переведены в раствор действием окислителей, например, по реакциям:
2As + 5Сl2 + 8H2 O = 2H3 AsO4 + 10HCl
Bi + 4HNO3 = Bi(NO3 )3 + NO + 2H2 O
Растворимые производные всех трех элементов весьма ядовиты.
При нагревании на воздухе As, Sb и Bi сгорают с образованием окислов, общей формулы Э2 О3 . Легко соединяются они также сгалоидами и серой. Образование определенных соединений с металлами для рассматриваемых элементов менее характерно, чем дляазота и фосфора, однако все же известны некоторые аналогичные нитридам и фосфидам арсениды, антимониды и висмут иды, например Mg3 As2, Mg3 Sb2 и Mg3 Bi2.
Действием на них разбавленных кислот могут быть получены аналогичные аммиаку и фосфину мышьяковистый («арсин»), сурьмянистый («стибин») и висмутистый («висмутин») водороды общей формулы ЭН3 . Реакции идут по схеме:
Mg3 Э2 + 6HCl = 3MgCl2 + 2ЭH3
Так как соединения эти малоустойчивы, больший или меньший распад их на элементы имеет место уже в момент образования и поэтому практически они всегда выделяются в смеси с водородом. Особенно это относится к BiH3 , который из–за своей чрезвычайной неустойчивости до сих пор почти не изучен.
Арсин и стибин представляют собой бесцветные, очень ядовитые газы с чесночным (AsH3 ) или похожим на сероводородный (SbH3 ) запахом. Их точки плавления и кипения сопоставлены ниже с соответствующими данными для аммиака и фосфина:
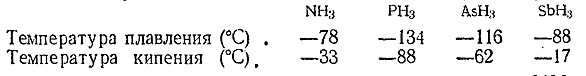
Восстановительная активность гидридов в ряду NH3 – РН3 – AsH3 –SbH3 последовательно возрастает. Столь характерные для аммиакареакции присоединения вовсе не наблюдаются у арсина и стибина. Оба они довольно хорошо растворимы в воде, но химически с ней не взаимодействуют. При нагревании AsH3 и SbH3 легко разлагаются на элементы, а будучи подожжены на воздухе, сгорают с образованием воды и соответствующих окисей.
3) Помимо разложения арсенидов и антимонидов кислотами, арсин и стибин могут быть получены также действием водорода в момент выделения на самые разнообразные растворимые соединения мышьяка и сурьмы, например по реакции
As2 O3 + 6Zn+12HCl = 6ZnCl2 + 2AsH3 + 3H2 O
На такой реакции, в сочетании с термическим разложением АsН3 , основан один из методов открытия мышьяка.
Окиси As, Sb и Bi отвечают формуле Э2 О3 . Они легко образуются при нагревании элементов на воздухе и представляют собой твердые вещества белого (As2 O3 и Sb2 O3 ) или желтоватого (Вi2 О3 ) цвета. Мышьяковистый ангидрид (AS2 O3 ) довольно хорошо растворим в воде, тогда как обе другие окиси почти нерастворимы.
Химические свойства отвечающих окисям гидроокисей Э(ОН)3 по ряду As – Sb – Bi изменяются весьма закономерно. Все они амфотерны, причем у As(OH)3 преобладает кислотный характер, у Sb(OH)3 – основной, а у Вi(ОН)3 кислотная функция выражена столь слабо, что обнаруживается лишь по незначительной растворимости этой гидроокиси в крепких растворах сильных щелочей. Таким образом, кислотный характер гидроокисей Э(ОН)3 в ряду As–Sb–Bi быстро ослабевает.
Мышьяковистая кислота (H3 AsO3 ) известна лишь в растворе. Гидроокиси сурьмы (иначе, сурьмянистая кислота) и Bi(OH)3представляют собой белые осадки. Для обоих элементов характерны продукты частичного обезвоживания гидратов– SbO(OH) и ВiO(ОН). Отвечающие им радикалы SbO (антимонил) и BiO (висмутил) часто входят как таковые в состав солей и играют в них роль одновалентных металлов.
Растворенная часть гидроокисей As и Sb способна диссоциировать одновременно по суммарным схемам:
Э3+ + 3OH– < = > Э(OH)3 ≡≡≡ H3 ЭO3 < = > 3H+ + ЭO3 3–
При добавлении к раствору кислот равновесия смещаются влево и образуются соли катионов Э3+, а при добавлении щелочейравновесия смещаются вправо и получаются соответственно мышьяковистокислые (арсениты) или сурьмянистокис–лые (антимониты)соли с анионом ЭО3 3– . Кислотная диссоциация может протекать также с отщеплением молекулы воды по типу
H3 ЭO3 < = > H+ + ЭO2 – + H2 O
причем получаются соли мета–мышьяковистой (НАsО2 ) и метасурьмянистой (HSbO2 ) кислот. Обе они являются очень слабыми.
4) Кислотной диссоциации Н3 АsО3 отвечают значения K1 = 4·10–10, K2 = 7·10–13 и K3 = 4·10–14, а для основной диссоциации As(OH)3известно лишь значение K1 = 5·10–15. Таким образом, обе функции выражены весьма слабо, однако кислотная все же значительно сильнее основной. Для мышьяковистой кислоты особенно характерен практически нерастворимый в воде желтый арсе–нит серебра(Ag3 AsO3 ), а для сурьмянистой (K1 = 10–11) – труднорастворимый бесцветный метаантимонит натрия, выделяющийся обычно в видекристаллогидрата NaSbO2 ·3H2 O.
Так как основные свойства гидроокисей Э(ОН)3 в ряду As–Sb–Bi усиливаются, возрастает и устойчивость солей с катионом Э3+. В частности, соли кислородных кислот для As3+ вообще не выделены, для Sb3+известны лишь единичные их представители, тогда как бесцветный Bi(NO3 )·5H2 O является наиболее обычным соединением висмута. Растворимые производные Sb3+и Bi3+легко разлагаютсяводой с выделением основных солей.
Параллельно с ослаблением кислотных и усилением основных свойств гидроокисей Э(ОН)3 в ряду AsIII–SbIII– ВiIIIослабляются также и восстановительные, т. е. уменьшается тенденция элементов к переходу в соединения их высшей валентности.
Мышьяковистая кислота, будучи сильным восстановителем в щелочной среде, в кислой окисляется уже значительно труднее. Сурьмянистая кислота типичным восстановителем вообще не является, хотя окисление ее в щелочной среде и идет довольно легко. Наконец, гидроокись висмута может быть окислена только в сильнощелочной среде и наиболее сильными окислителями.
Высшие окислы As и Sb– мышьяковый ангидрид (As2 O5 ) и сурьмяный ангидрид (Sb2 O5 ) могут быть получены нагреванием ихгидратов, образующихся при окислении As и Sb крепкой азотной кислотой. Мышьяковый ангидрид представляет собой белую стекловидную массу, расплывающуюся на воздухе. Желтоватый порошок сурьмяного ангидрида очень мало растворим в воде.
Отвечающая As2 O5 мышьяковая кислота (H3 AsO4 ) может быть получена по реакции:
3As + 5HNO3 + 2H2 O = 3H3 AsO4 + 5NO
Она легко растворима в воде и приблизительно равна фосфорной по силе. Для Sb2 O5 определенные гидратные формы нехарактерны, и белый аморфный осадок Sb2 O5 ·3Н2 О изменяет свой состав независимости от условий выделения. В воде он почти нерастворим. Кислотные свойства сурьмяной кислоты выражены довольно слабо.
Соли мышьяковой кислоты (мышьяковокислые, или арсенаты) производятся главным образом от оргогидрата (H3 AsO4 ). Солисурьмяной кислоты (сурьмянокислые, или антимонаты) производятся обычно от гексагидроксисурьмяной кислоты – H[Sb(OH)6 ], отвечающей гидратированной мета–форме: HSbO3 ·3H2 O. Подобно фосфатам, арсенаты и антимонаты, как правило, бесцветны и труднорастворимы в воде.





























