Для азота известны окислы, по составу формально отвечающие всем валентностям от . единицы до пяти. Их формулы и названия сопоставлены ниже:
N2 O – закись азота
NO – окись азота
N2 O3 – азотистый ангидрид
NO2 – двуокись азота
N2 O5 – азотный ангидрид
Азотный ангидрид пpeдcтaвляeт собой твердое вещество, а остальные окислы при обычных условиях газообразны.
1) За исключением NO2 , все окислы азота ядовиты. При взаимодействии с раскаленной медьюони полностью разлагаются, образуя СuО и N2 . По количеству окиси меди и азота может быть установлена формула исходного окисла.
Закись азота может быть получена разложением азотнокислого аммония, протекающим около 200 °С по уравнению:
NH4 NO3 = 2Н2 О + N2 O
Структура молекулы N2 O соответствует формуле N≡N = O. 3акись азота представляет собой бесцветный газ (т. пл. –91 °С, т. кип. –89°С) со слабым приятным запахом. В воде она довольно хорошо растворима, но химически с ней не взаимодействует. Выше 500°С закись азотаразлагается по реакции:
2N2 O = 2N2 + О2
Поэтому при повышенных температурах она действует как сильный окислитель. Например, тлеющая лучина вспыхивает в ней.
Так как температура человеческого тела далеко недостаточна Для разложения N2 O, этот газ, поддерживающий горение, дыхания не поддерживает. Вдыхание закиси азота в смеси с воздухом вызывает характерное состояние опьянения, сопровождающееся значительным ослаблением болевых ощущений. На этом основано использование N2 O при операциях в качестве наркотика.
2) Молекула N2 O линейна [d(NN) = 1,13 А, d(N0) = 1,19 А]. Закись азота является постоянной составной частью воздуха (0,00005% по объему). Один объем воды поглощает при 0°С около 1,3, а при 25 °С – 0, 6 объема N2 O.
Образование окиси азота из элементов при обычных условиях не происходит. Лишь примерно с 1200 °С начинает заметно протекать обратимая реакция:
N2 + О2 + 43 ккал < = >2NO
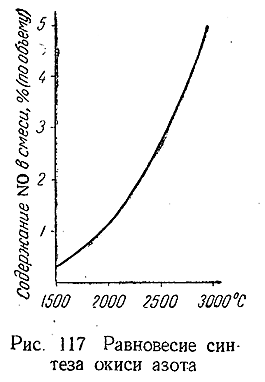
Как видно из рис. 117, около 1500°С равновесие еще почти нацело смещено влево. Устанавливается оно при этих условиях чрезвычайно медленно: для достижения равновесного состояния требуется30 часов. Напротив, более высоким температурам отвечает не только большее содержание N0 в газовой смеси, но и несравненно быстрейшее достижение равновесия, которое при 3000°С устанавливается за миллионные дбли секунды. По Этим причинам NO всегда образуется в атмосфере при грозовьц разрядах.
Несмотря на эндотерйичность окиси азота, при обычных условиях она вполне устойчива. В лабораториях ее чаще всего получают пореакции:
3Cu + 8HNO3 = 3Cu(NO3 )2 + 2NO + 4Н2 О
Окись азота представляет собой бес цветный газ (т. пл. –164 °С, т. кип. –151°С), сравнительно малорастворимый в воде и химически с ней не взаимодействующий. Свой кислород она отдает лишь с трудом. Поэтому горящая лучина в атмосфере NO гаснет.
Наиболее характерны для окиси азота реакции присоединения. Так, при взаимодействии ее с хлором по реакции
2NO + Сl2 = 2NOCl
образуется хлористый нитрозил (Сl–N = O), представляющий собой желтый газ (т. пл. – 64°С, т. кип. –6°С). Непосредственно соединяется NO и с кислородом. Известен также ряд комплексных соединений, содержащих NO во внутренней сфере.
3) Молекула NO характеризуется расстоянием d(NO) = 1,15 А и очень малой полярностью (длина диполя 0,03 А). Сто объемов водырастворяют при 0°С около 7 объемов окиси азота. В жидком и твердом состояниях она имеет синий цвет.
4) Если подсчитать общее число внешних электронов в молекуле NO, то получается цифра 11 (5 у азота и 6 у кислорода). Так как валентная связь осуществляется электронной парой, последняя должна быть системой более устойчивой, чем неспаренный электрон. Можно поэтому ожидать, что молекулы с нечетным числом электронов («нечетные» молекулы) будут склонны к димеризации (т. е. попарному сочетанию). Как правило, это и наблюдается уже при обычных условиях. К очень немногочисленным исключениям относится окись азота, проявляющая заметные признаки димеризации по схеме
NO + NO < = > N2 O2
лишь при низких температурах. В жидком состоянии при –163 °С содержание молекул N2 O2 достигает 95, а твердая окись азотасостоит, по–видимому, уже только из таких молекул.
Спокойно протекающая реакция соединения NO с кислородом воздуха ведет к образованию двуокиси азота по уравнению:
2NO + O2 = 2NO2 + 27 ккал
Двуокись азота представляет собой бурый газ, легко сгущающийся в жидкость, кипящую при +21 °С. Будучи охлаждена до –11 °С,жидкость эта застывает в бесцветную кристаллическую массу. Определение молекулярного веса по плотности пара дает цифры, лежащие между простым (14 + 2 ·16 = 46) и удвоенным (92) его значениями, причем цифры эти зависят от температуры опыта, уменьшаясь при ее повышении и увеличиваясь при понижении.
5) Реакция присоединения кислорода к NO особенно интересна тем, что она является одним из очень немногих известных случаев, когда при повышении температуры химический процесс не только не ускоряется, но даже несколько замедляется. Объяснение этой аномалии скорости исходит из того, что в реакцию вступают лишь димерные молекулы N2 O2 , вероятность возникновения которых с повышением температуры очень быстро уменьшается.
Такие результаты обусловлены наличием равновесия между молекулами двуокиси азота (NO2 ) и азотноватой окиси (N2 O4 ). Результаты определения молекулярного веса около 140 °С показывают, что при этих условиях в газе имеются только молекулыдвуокиси азота, тогда как при более низких температурах они частично соединяются попарно, образуя молекулы N2 O4 . Так как процесс образования из нейтральных молекул одного и того же вещества более сложных частиц с удвоенным, утроенным и т. д. молекулярным весом называется полимеризацией, можно сказать, что ниже 140 °С NO2 частично полимеризуется (точнее – димеризуется) в N2 O4 . Это происходит тем в большей степени, чем ниже температура, и вблизи точки замерзания (–11°С) вещество состоит уже исключительно из молекул N2 O4 . Напротив, при нагревании азотноватой окиси она диссоциирует на простые молекулы.
Каждой промежуточной между –11 °С и +140сС температуре отвечает определенное состояние равновесия обратимой реакции:
полимеризация–––––––––––––––––>>>
NO2 + NO2 < = > N2 O4 + 13 ккал
<<<––––––––––––––––
диссоциация
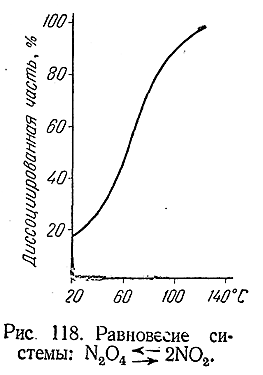
Положения этого равновесия при различных температурах показаны на рис. 118. Так как N2 O4 бесцветна, a NO2 имеет красно–бурый цвет, за смещением равновесия при нагревании или охлаждении газовой смеси легко следить по изменению ее окраски.
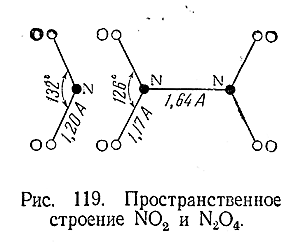
Склонность молекул O = N = O к взаимодействию друг с другом обусловлена наличием в каждой из них одного непарного электрона (приатоме азота). Сочетание двух таких электронов и создает связь N–N в молекуле N2 O4 . Неустойчивость последней является следствием непрочности этой связи. Пространственное строение молекул NO2 и N2 O4 показано на рис. 119.