Рассмотренные в предыдущем параграфе реакции присоединения аммиака не укладываются в рамки обычных представлений о валентной связи. Действительно, молекулы и самого аммиакаи вступающего с ним во взаимодействие вещества (например, НСl) электрически нейтральны и образованы в полном соответствии с требованиями теории валентности. Ми одно из вступающих в реакцию веществ не содержит, следовательно, способных осуществить валентную связь непарных электронов. Между тем опыт показывает, что присоединение все же имеет место.
Указания на характер протекающего при взаимодействии аммиака с кислотами процесса дают сами свойства получающихся продуктов – солей аммония. Так как последние в растворе всегда отщепляют ион NH4 +, при образовании их должно происходить соединение нейтральноймолекулы аммиака с ионом водорода. Для реакции, например, между NH3 и НСl это может быть наглядно выражено следующей схемой:
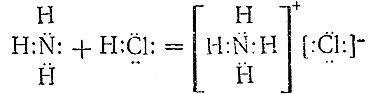
Из схемы вытекает, что азот аммиака перетягивает к себе ион водорода от хлора. В противоположность химическим реакциям, ведущим к возникновению обычных валентных связей (III § 4), рассматриваемый процесс не сопровождается образованием новых электронныхпар (или, по Косселю, переходом электронов). Подобные хлористому аммонию молекулярные соединения определенного состава, образование которых из более простых молекул не связано с возникновением новых электронных пар, называются комплексными. В качестве отдельно рассматриваемой составной части ряда сходных комплексных соединений часто бывает целесообразно выделять комплексный ион. Например, комплексный ион NH4 содержится во всех солях аммония, которые сами являются комплексными соединениями.
1) Существуют два основных подхода к теории образования комплексных соединений. С точки зрения электростатического подхода образование комплексного соединения происходит за счет кулоновского притяжения частиц и их взаимной поляризации. Например, при взаимодействии аммиака с НСl ион водорода одновременно притягивается и ионом хлора, иазотом аммиака Так как притяжение азотом выражено более сильно, образуется соль аммония с катионом NH4 и анионом Cl– на которые она и распадается при растворении в воде.
В основе другого подхода лежит допущение существования так называемой донорно–акцепторной (иначе, координативной) связи По этим представлениям, обладающие свободными электронными парами атомы имеют тенденцию использовать их для связи с другими частицами. Вместе с тем не обладающие законченной электронной конфигурацией атомы имеют тенденцию пополнить свой внешний электронный слой путем использования чужих электронных пяр. Атомы первого типа носят название доноров, второго – акцепторов Если обе тенденции выражены достаточно сильно, то между атомами возникает связь за счет электронной пары донора. Например, образование иона NH4 происходит за счет свободной электронной пары атома N и имеет место потому, что азот аммиака является лучшим донором, чем ион хлопа.
При сопоставлении процессов образования обычной валентной и донорно–акцепторной связей получаются следующие схемы:
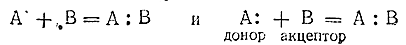
Из этих схем видно, что оба процесса различаются происхождением связующей электронной пары, но сами образующиеся в конечном счете связи однотипны (и имеют более или менее четко выраженный ковалентный характер).
В структурных формулах соединений донорно–акцепторную связь обозначают не простой чертой (как обычную валентную), а стрелкой, направленной от донора к акцептору. Приведенные выше схемы можно было бы поэтому переписать следующим образом:
A· + B = А–B
и
A: + B = A––>B
2) Обе рассмотренные выше точки зрения не исключают, а взаимно дополняют друг друга. Это становится ясным, если учесть, что дальность действия различных сил существенно зависит от их природы:

Как видно из схемы, последовательно сближающиеся частицы первоначально взаимодействуют друг с другом только электростатически, Если по каким–либо причинам дальнейшее сближение невозможно, то дело этим практически ограничивается. Напротив, если частицы могут подойти друг к другу, достаточно близко (на расстояние, не слишком превышающее сумму радиусов непосредственно сближающихся атомов), то становится возможным образование обычных ковалентных и донорно–акцепторных связей.Прочность последних и их относительное значение в обшей энергии комплексной связи все более возрастают по мере дальнейшего сближения частиц.
Из изложенного следует, что в общем случае комплексную связь можно рассматривать как сочетание электростатической и донорно–акцепторной. Лишь тогда, когда значение какого–либо из этих видов взаимодействия настолько доминирует, что практически допустимо считаться только с ним, становится приближенно правильной одна из рассмотренных выше трактовок.
Приведенная схема образования NH4 Cl наглядно показывает, что центральное положение в этом комплексном соединении В занимаетазот. Такой центральный атом (или ион) называется комплексообразователем. Другие составные части рассматриваемогокомплексного соединения по отношению к комплексообразо–вателю расположены различно: в то время как водороды непосредственно связаны с ним (находятся во внутренней сфере комплекса), ион хлораболее удален (находится во внешней сфере) и, следовательно, связан значительно слабее, Различие между внутренней и внешней сферами часто оттеняют в формулах тем, что заключают первую (вместе с комплексообразователем) в квадратные скобки. Например, написание хлористого аммония в комплексной форме будет [NH4]Cl. Как эта формула, так и приведенная выше схема подчеркивают полную равноправность всех четырех расположенных около азотаводсродов, независимо от того, какой именно из них заключался в первоначально взятом аммиаке и какой был присоединен впоследствии.
3) Очевидно, что перетягивание иона водорода к азоту аммиака будет происходить тем легче, чем слабее он удерживается кислотным остатком соответствующей кислоты (т. е. чем последняя сильнее), Поэтому теплоты образования солей аммония и сильных кислотбольше, чем слабых. Например, для НСl и Н2 О (рассматривая ее как слабую кислоту) имеем:
NH3 + HCl = NH4 Сl + 42 ккал
и
NH3 + НОН = NH4 OH + 8 ккал
Наоборот, разложение солей аммония на аммиак и кислоту идет тем легче, чем сильнее кислотный остаток притягивает ион водорода(т. е. чем кислота слабее). Поэтому, например, NH4 Cl разлагается только около 300 °С, тогда как свободный NH4 OH совершенно неустойчив уже при обычной температуре.
Образование комплексных соединений рассматривалось выше на примере аммонийных солей, где комплексообразователем являетсяазот аммиака. Однако значительно чаще приходится иметь дело с комплексообразованием около свободных ионов.
Для рассмотрения этого случая обратимся прежде всего к взаимодействию ионов с молекулами воды. Как уже отмечалось ранее (V § 4), под действием создаваемого ионом электрического поля молекулы воды определенным образом ориентируются и затем притягиваются к иону противоположно заряженным концом диполя. За счет такого притяжения в растворе образуется гидра–тированный ион. Допустим теперь, что раствор все более концентрируется. На известной стадии из него станут выделяться кристаллы растзоренноговещества, заключающие в своем составе и рассматриваемый ион. Если при этом непосредственно окружающие его в растворемолекулы воды связаны с ним непрочно, то вода не войдет в состав кристалла. Напротив, если связь иона с молекулами водыдостаточно прочна, то в состав кристалла он войдет с некоторым числом молекул «кристаллизационной» воды. В результате получитсякристаллогидрат данного вещества, представляющий собой, по существу комплексное соединение. Например, фиолетовыйкристаллогидрат СrСl3 ·6Н2 О является в действительности комплексным соединением [Сr(ОН2 )6 ]Сl3 , в котором около комплексообразователя (Сr3+) удерживаются во внутренней сфере шесть молекул воды. Подобным же образом как комплексные соединения следует рассматривать и многие другие кристаллогидраты солей.
Очевидно, что образование комплексного соединения может происходить при взаимодействии иона не только с водой, но и с другими нейтральными молекулами. Например, при действии аммиака на водный раствор СuСl2 образуется комплекс состава [Cu(NH3 )4 ]Cl2 , диссоциирующий на ионы [Cu(NH3 )4 ]2+и 2Сl–. С другой стороны, комплексообразование не обязательно должно протекать в растворе– комплексные соединения часто образуются и при взаимодействии твердых веществ с газообразными. Например, безводный СаСl2 ватмосфере аммиака дает комплекс состава [Ca(NH3 )8 ]Cl2 . Сущность самого процесса остается при этом той же самой и заключается в присоединении нейтральных молекул к тому или иному иону соли за счет возникающего между ними взаимного притяжения.
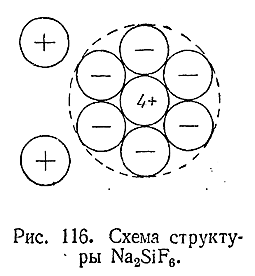
Такое притяжение действует не только между ионом и нейтральной молекулой, но в еще большей степени между разноименно заряженными ионами. Пусть, например, к какому–либо положительному иону притягивается одновременно несколько отрицательных. Если при этом взаимное отталкивание последних слабее их притяжения к комплексообразователю, то получающаяся группировка может оказаться настолько устойчивой, что будет существовать как таковая и в твердом состоянии и в растворе. Например, в Na2 [SiF6 ]ионы фтора притягиваются к Si4+сильнее,чем отталкиваются Друг от друга(рис. 116). Соединение это диссоциирует вводном растворепо схеме:
Na2 [SiF6 ] < = > 2Na+ + [SiF6 ]2–
Наконец, вполне возможен случай, когда к данному иону одновременно будут притянуты и ионы противоположного знака и нейтральныемолекулы. Если при этом и те и другие удерживаются комплексообразо–вателем достаточно прочно, комплексное соединениеподобного типа, например [Pt(NH3 )4 Cl2 ]Cl2 , будет устойчиво, давая в растворе катионы [Pt(NH3 )4 Cl2 ]2+ и анионы хлора.