Общее содержание азота в земной коре оценивается величиной порядка 0,03%. Наибольшая его часть сосредоточена в атмосфере, основную массу которой (75,5% по весу) и составляет свободный азот (N2 ). Сложные органические производные азота входят в состав всех живыхорганизмов. В результате отмирания последних и тления их останков образуются более простые азотные соединения, которые при благоприятных условиях (главным образом – отсутствии влаги) могут накапливаться. Именно такого, по–видимому, происхождения залежи NaNO3 в Чили, имеющие некоторое промышленное значение как один из источников получения связанного азота (т. е. азота в виде соединений).
Так как свободный азот содержится в атмосфере, получение его сводится к отделению откислорода и других составных частей воздуха. Это осуществляется постепенным испарениемжидкого воздуха в специальных установках, причем одновременно получаются также кислород иинертные газы. В лабораторных условиях азот может быть получен, например, по реакции
NH4 NO2 = 2Н2 О + N2
которая легко протекает при нагревании концентрированного раствора азотистокислогоаммония (или смеси NaNO2 + NH4 Cl).
Азот представляет собой бесцветный и не имеющий запаха газ (т. пл. –210°С, т. кип. –196°С).Растворимость его в воде мала – около 2% по объему. Молекула азота двухатомна и заметно не распадается на атомы даже при очень высоких температурах.
Свободный азот химически весьма инертен. В обычных условиях он не реагирует ни сметаллоидами, ни с металлами (кроме Li). При повышении температуры его активностьувеличивается главным образом по отношению к металлам, с некоторыми из которых он при нагревании соединяется, образуя нитриды этих металлов (например, Mg3 N2 ).
Применение свободного азота, как такового, довольно ограниченно. Главным образом его используют для заполнения электроламп. Соединения азота имеют громадное значение для биологии и используются в разнообразных отраслях промышленности. Наибольшие их количества расходуются в качестве минеральных удобрений и при производстве взрывчатых веществ.
Основным исходным продуктом для промышленного получения азотных соединений является свободный азот воздуха. Перевод его в связанное состояние осуществляется главным образом методом синтеза аммиака, разработанным в 1913 г.
Приложение к обратимой реакции
N2 + ЗН2 < = > 2NH3 + 22 ккал
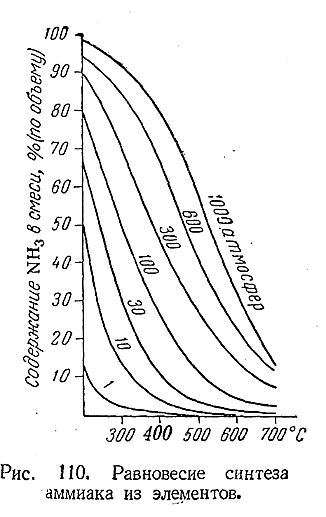
принципа смещения равновесий показывает, что наиболее выгодными для образования аммиака условиями являются возможно низкаятемпература и возможно высокое давление. На рис. ПО даны кривые, характеризующие положение равновесия рассматриваемой системы при различных условиях. Как видно из рисунка, выгодные соотношения устанавливаются только при сравнительно низкихтемпературах и высоких давлениях. Однако даже при 700°С скорость реакции настолько мала (и следовательно, равновесиеустанавливается так медленно), что не может быть и речи о ее практическом использовании. Напротив, при более высокихтемпературах, когда равновесное состояние устанавливается быстро, ничтожно малым становится содержание аммиака в системе. Таким образом, техническое проведение рассматриваемого процесса оказывается как будто невозможным, так как, ускоряя достижениеравновесия при помощи нагревания, мы одновременно смещаем положение равновесия в невыгодную сторону.
Существует, однако, средство ускорить достижение равновесного состояния без одновременного смещения равновесия. Таким часто помогающим средством является применение подходящего катализатора.
Хорошо действующим оказалось в данном случае металлическое железо (с примесью Аl2 О3 и К2 О).
Схема одного из типов заводской установки для синтеза аммиака показана на рис. 111.





























