Фосфор относится к весьма распространенным элементам – на его долю приходится около 0,04% от общего числа атомов земной коры. Он имеет исключительное значение для жизни, так как входит в состав некоторых белковых веществ (в частности, нервной и мозговой тканей), а также костей и зубов. Скопления фосфора встречаются главным образом в виде минералаапатита [Са5 Х(РО4 )3 , где X = F, реже Сl или ОН] и залежей фосфоритов, состоящих из Са3(РО4 )2 с различными примесями.
Свободный фосфор получают из природного фосфорнокислого кальция накаливанием его с песком (SiO2 ) и углем в электрической печи. Процесс протекает по суммарному уравнению:
Са3 (РО4 )2 + 3SiO2 + 5С = 3CaSiO3 + 5СО + 2Р
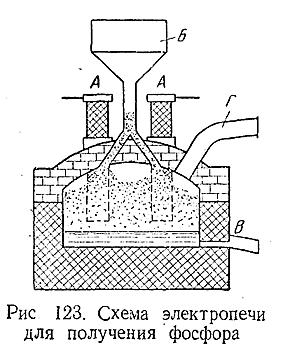
Схема электропечи для получения фосфора показана на рис. 123 (А – массивные угольныеэлектроды, Б – загрузка смеси фосфата с песком и углем, В – вывод жидкого шлака, Г – выход паров фосфора). Образующиеся парыфосфора отводят в орошаемые водой конденсаторы и затем собирают в приемнике с водой, под слоем которой расплавленный фосфори накапливается.
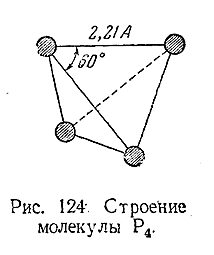
В парах (ниже 800°С) и в жидком состоянии фосфор четырехатомен, причем молекула Р4 имеет структуру правильного тетраэдра (рис. 124). Для твердого фосфора известно несколько аллотропических модификаций, из которых практически приходится встречаться с двумя – белой и красной.
В результате охлаждения паров фосфора получается белая форма. Она характеризуется плотностью 1,8, т. пл. 44°С и т. кип. 281 °С. Вводе белый фосфор практически нерастворим, но хорошо растворяется в сероуглероде (CS2). Хранят его под водой и по возможности в темноте.
При хранении белого фосфора он постепенно (очень медленно) переходит в более устойчивую красную форму. Переход сопровождается выделением тепла (теплота перехода):
Pбелый = Pкрасный + 4 ккал
Процесс ускоряется при нагревании и под действием света. Практически красный фосфор получают длительным нагреванием белого до 280–340 °С (в герметизированной аппаратуре). Наибольшие его количества потребляются спичечным производством.
Красный фосфор представляет собой порошок с плотностью 2,3, нерастворимый в сероуглероде и при нагревании возгоняющийся (т. возг. 416 °С). Пары его, сгущаясь, вновь дают белый фосфор. Последний, в противоположность красному, очень ядовит.
Химическая активность фосфора значительно выше, чем у азота. Так, он легко соединяет ся с кислородом, галоидами, серой и многимиметаллами. В последнем случае образуются аналогичные нитридам фосфиды (Mg3 P2 , Ca3 P2 и др.).
Белый фосфор значительно более реакционноспособен, чем красный. Например, белый фосфор медленно окисляется на воздухе даже при низких температурах и воспламеняется уже около 50 °С, тогда как красный фосфор на воздухе почти не окисляется, а воспламеняется лишь при 250°С. Точно так же и другие реакции протекают с белым фосфором гораздо энергичнее, чем с красным. Подобное различие реакционной способности аллотропических модификаций является общим случаем: из двух форм одного и того жевещества менее устойчивая обычно более активна.
1) Нагреванием белого фосфора до 220 °С под давлением 12 000 ат можетбыть получен черный фосфор с плотностью 2,7. Он похож по внешнему виду на графит, довольно хорошо проводит электричество и химически несколько менее активен, чем красный фосфор.
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например
Са3 Р2 + 6Н2 О = ЗСа(ОН)2 + 2РН3
может быть получен аналогичный аммиаку фосфористый водород («фосфин») – РН3 . Последний представляет собой бесцветный, весьма ядовитый газ (т. пл. –134 °С, т. кип. –88°С). Он имеет неприятный запах («гнилой рыбы»), легко воспламеняется на воздухе и является очень сильным восстановителем. В противоположность аммиаку реакции присоединения для фос–фина малохарактерны:соли фосфония (РН4 )известны лишь для немногих кислот (НСlO4 , НCl, HBr, HJ) и весьма нестойки, а с водой фосфин химически не взаимодействует (хотя довольно хорошо растворим в ней).
2) Наряду с РН3 при разложении .водой фосфидов всегда образуются небольшие количества аналогичного по составу гидразину жидкого фосфористого водорода – Р2 Н4 . Последний представляет собой бесцветную жидкость (т. пл. –99 СС, т. кип. 52 °С), самовоспламеняющуюся на воздухе.
Одним из применяемых для получения РН3 методов является нагревание белого фосфора с крепким водным раствором щелочи.Реакция идет, например, по уравнению:
8Р + ЗВа(ОН)2 + 6Н2 О = 2РН3 + ЗВа(Н2 РО2 )3
Одновременно образуется соль фосфорноватистой кислоты.
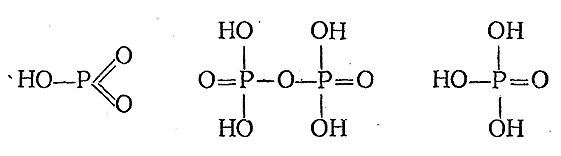
Действием на эту соль H2 SO4 может быть получена свободная фосфорноватистая кислота (Н3 РО2 ). Несмотря на наличие в еемолекуле трех водородов, она является только одноосновной кислотой (и довольно сильной), что согласуется со структурной формулой:
Соли фосфорноватистой кислоты (г и п о ф о сф и ты), как правило, бесцветны и хорошо растворимы в воде.
3) Фосфорноватистая кислота (K = 9·10–2) представляет собой бесцветные кристаллы (т. пл. 27 °С), хорошо растворимые в воде. В сильнокислой среде (особенно при нагревании) она является энергичным восстановителем. Например, соли ргути восстанавливаются ею до металла:
HgCl2 + H3 PO2 + H2 O = H3 PO3 + Hg + 2HCl
Напротив, в разбавленных растворах на холоду Н3 РО2 не окисляется ни кислородом воздуха, ни свободным иодом.
Взаимодействие фосфора с кислородом в зависимости от условий ведет к образованию различных продуктов. При сгорании фосфора в избытке кислорода (или воздуха) получается его высший окисел – фосфорный ангидрид (Р2 О5 ). Напротив, горение при недостаткевоздуха или медленное окисление дает в результате главным образом фосфористый ангидрид (Р2 О3 ).
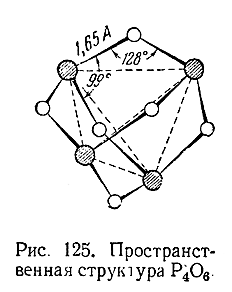
Последний представляет собой белую, похожую на воск кристаллическую массу (т. пл. 24 °С, т. кип. 175 °С). Определения егомолекулярного веса приводят к удвоенной формуле (Р4 О6 ), которой отвечает показанная аа рис. 125 пространственная структуру.
При нагревании на воздухе фосфористый ангидрид переходит в Р2 О5 . Постепенно это окисление идет уже в обычных условиях, причемреакция сопровождается свечением, которое можно наблюдать в темноте. Взаимодействуя с водой, Р2 О3 –медленно образуетфосфористую кислоту:
Р2 О3 + ЗН2 О = 2Н3 РО3
Подобно белому фосфору, фосфористый ангидрид очень ядовит.
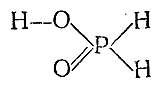
Свободная фосфористая кислота(Н3 РО3 ) представляет собой бесцветные кристаллы, легкорастворимые в воде. Она является сильным (но в большинстве случаев медленно действующим) восстановителем. Несмотря на наличие в молеку ле трех водородов, Н3РО3 функционирует только как двухосновная кислота средней силы. Соли ее (фосфористокислые, или фосфиты), как правило, бесцветны и труднорастворимы в воде. Из производных чаще встречающихся металлов хорошо рас–воримы лишь соли Na, К и Са.
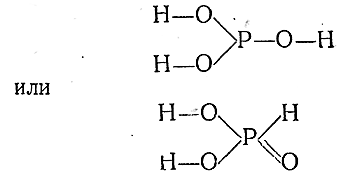
Строение фосфористой кислоты может быть выражено следующими структурными формулами:
Самой кислоте отвечает вторая формула, а производные ее известны для обеихструктур.
4) Фосфористую кислоту (т. пл. 74 °С, K1 = 2·10–2, К2 = 2 ·10–7) удобно получать гидролизом РСl3 и последующим упариваниемжидкости до начала кристаллизации. Кислородом воздуха ее растворы при обычных условиях заметно не окисляются. Взаимодействие ее с хлорной ртутью медленно идет по уравнению
Н3 РО3 + 2НgСl2 +Н2 О = Н3 РО4 + Нg2 Сl2 + 2НСl.
Наиболее характерный для фосфора окисел – фосфорный ангидрид (Р2 О5 ) представляет собой белый аморфный порошок, не имеющий запаха и при сильном нагревании возгоняющийся.
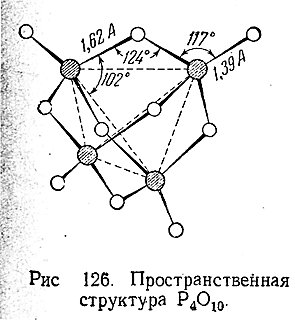
Определение его молекулярного, веса в парах указывает на удвоенную формулу – Р4 О10 , которой отвечает приводимая на Рис. 126 пространственная структура. Фосфорный ангидрид чрезвычайно энергично притягивает влагу и поэтому часто применяется в качестве осушителя газов.
Взаимодействие Р2 О5 с водой сопровождается ее присоединением, причем в зависимости от числа присоединенных молекул Н2 О возможно образование следующих основных гидратных форм:
P2 O5 + H2 O = 2HPO3 (метафосфорная кислота)
P2 O5 + 2H2 O = H4 P2 O7 (пирофосфорная кислота)
P2 O5 + 3H2 O = 2H3 PO4 (ортофосфорная кислота)
Как видно из приведенного сопоставления, наиболее богата водой орто–кислота, которую обычно называют просто фосфорной. При ее нагревании происходит отщепление воды, причем последовательно образуются пиро– и мета–формы:
2Н3 РО4 = Н2 О + Н4 Р2 О7
и
Н4 Р2 O7 = Н2 О+2НPO3
Обратно, при действии воды на мета–форму она переходит в пиро– и затем в орто–форму. Однако переход этот на холоду протекает крайне медленно. Поэтому каждая кислота реагирует как индивидуальное вещество. Их структурные формулы приводятся ниже: