Из относящихся к этой подгруппе элементов № 85 – астат (At) –в земной коре отсутствует и был получен искусственно. Так как исследованию подвергались лишь ничтожлые его количества, свойства этого элемента почти не изучены.
Содержание в земной коре брома составляет 3·10–5%, а иода 4·10–6%. По характеру распределения в природе оба элемента похожи на хлор, но образование скоплений для них не характерно.
Основными источниками промышленного получения брома являются воды некоторых соляных озер (0,01–0,5% Br) и морская вода (в среднем 0,007% Вr). Частично он добывается также из бромистых соединений, незначительные примеси которых обычно содержатся в природных месторождениях калийных солей, и из буровых вод нефтеносных районов (0,01–0,1% Вr).
Для промышленной добычи иода основное значение имеют именно буровые воды, содержащие в среднем 0,003% J. Другим источником этого элемента являются морские водоросли, зола которых содержит обычно до 0,5% J.
При получении свободных брома и иода чаще всего пользуются вытеснением их хлором пореакциям, например:
MgBr2 + Сl2 = MgCl2 + Вr2
2KJ + Сl2 = 2КСl + J2
Бром выделяется при этом в виде тяжелой буро–краснойжидкости, иод – в твердом состоянии. Ежегодная мировая добыча брома оценивается десятками тысяч тонн, иода – тысячами тонн.
По основным физическим свойствам бром и иод закономерно укладываются в один ряд схлором и фтором, как это видно из приводимой ниже таблицы (в которую включен такжеводород).

Довольно закономерно изменяется и устойчивость молекул рассматриваемых элементов – энергии их диссоциации, в общем (за исключением фтора), тем выше, чем меньше расстояние между ядрами:

Плотность брома равна 3,1, иода – 4,9. Так как давление пара твердого иода очень велико, он при нагревании обычно возгоняется.Возгонкой технического иода пользуются для его очистки.
Пары брома и иода обладают резким запахом. По действию на организм бром очень близок к хлору. Он находит наибольшее применение для выработки специальных добавок, повышающих качество моторных бензинов. В виде 5%–ного спиртового раствора(йодной настойки) иод применяется для стерилизации ран. Соединения обоих тяжелых галоидов широко применяются в фотографии, медицине и т. д.
Растворимость брома в воде составляет около 35 г, а иода–0,3 г на литр.. Оба эти галоида (и астат) гораздо лучше растворяются в различных органических растворителях, чем в воде.
1) При соприкосновении водного раствора галоида с органическим растворителем (не смешивающимся с водой) галоид распределяется между ним и водой в строго определенных отношениях. Если взять, например, бром и сероуглерод (CS2 ), то отношение концентрацииброма в сероуглеродной фазе к концентрации его в водной при различных общих количествах растворенного брома остается постоянным (и равным примерно 80). В этом постоянстве отношения концентраций (точнее – отношения активностей) распределяемого между двумя несмешивающимися растворителями вещества заключается так называемый закон распределения. Найденное отношение концентраций (в данном примере 80) называется коэффициентом распределения. Величина его (при постоянной температуре) характерна для данной системы: растворитель А – распределяемое вещество – растворитель Б. Распределение имеет большое техническое значение, так как часто позволяет избирательно извлекать то или иное вещество израствора смеси многих веществ.
По своей наиболее характерной химической функции бром к иод являются одновалентными металлоидами. Как уже указывалось ранее (§1), химическая активность одновалентного металлоида отчасти определяется величиной его сродства к электрону, т. е. той энергией, которая выделяется при присоединении избыточного электрона к соответствующему нейтральному атому. Очевидно, что для отрываэлектрона от отрицательного иона точно такое же количество энергии должно быть затрачено.
Ниже сопоставлены радиусы галоидных ионов Г' и соответствующие величины сродства нейтрального атома к электрону:
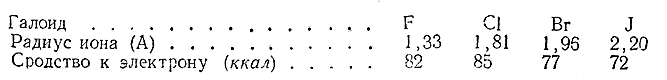
За исключением фтора, наблюдается та закономерность, которую можно было ожидать: чем дальше от ядра находится отрываемыйэлектрон, тем менее прочно он удерживается, т. е. тем меньше сродство к электрону данного нейтрального атома.
В связи с понижением металлоидной активности в ряду F–Cl–Br–J каждый галоид способен вытеснять все стоящие правее него из соединений. О вытеснении хлора фтором уже говорилось ранее (§ 2). Подобным же образом бром вытесняется из своих соединенийхлором, а иод–бромом.
И бром и иод являются все же весьма активными металлоидами. Со многими, металлами и некоторыми элементами металлоидного характера (например, фосфором) они способны взаимодействовать при обычных температурах. При этом бром по активности не очень сильно уступает хлору, тогда как иод отличается от него уже значительно.
2) Известные соединения брома, иода и других галоидов друг с другом сопоставлены в приводимой ниже таблице.

Все эти соединения образуются путем непосредственного взаимодействия элементов и являются веществами малоустойчивыми.
Взаимодействие с водородом брома происходит лишь при нагревании, а иода–только при более сильном нагревании и неполностью (так как начинает идти обратная реакция – разложение йодистого водорода). Сами по себе оба галоидоводорода почти не находят применения. Получать их удобно разложением водой соответствующих галоидных соединений фосфора по схеме:
PГ3 + ЗН2 О = Н3 РО3 + ЗНГ
Реакция легко идет уже при обычной температуре.
Подобно хлористому водороду, НВr и HJ представляют собой бесцветные газы, дымящие на воздухе и очень хорошо растворимые вводе. Некоторые их свойства сопоставлены со свойствами HF и НСl в приводимой ниже таблице и на рис. 100. В последний включены также радиусы ионов Г–, приблизительно характеризующие размеры молекул соответствующих галоидоводородов.
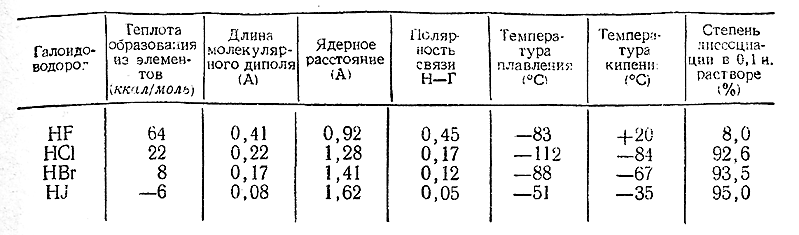
Как видно из рис. 100, в ряду HJ–HBr–HCl свойства изменяются весьма закономерно, тогда как при дальнейшем переходе к HF наблюдается более или менее резкий их скачок, иногда даже в направлении, обратном общему ходу. Обусловлено это сильной ассоциацией фтористого водорода, отсутствующей у его аналогов.
По химическим свойствам НВr и HJ очень похожи на хлористый водород. Подобно последнему, в безводном состоянии они не действуют на большинство металлов, а в водных растворах дают очень сильные бромисто–водородную и иодистово–дородную кислоты. Солипервой носят название бромистых или бромидов, второй – йодистых или иодидов (а производные галоидо–водородных кислот вообще –галоген идов или галидов). Растворимость бромидов и иодидов в большинстве случаев близка к растворимости соответствующиххлоридов. Существование в виде отрицательно одновалентного иона характерно в растворах и для астата.





























