По распространенности в природе хлор близок к фтору–на его долю приходится 0,02% от общего числа атомов земной коры. Человеческий организм содержит 0,25% хлора по весу.
Первичная форма нахождения хлора в природе отвечает его чрезвычайному распылению: небольшие количества этого элемента входят в состав самых различных минеральных породземнойкоры. В результате работы воды, на протяжении многих миллионов лет разрушавшей горные породы и вымывавшей из них растворимые составные части, соединения хлораскоплялись в морях. Усыхание последних привело к образованию во многих местах земного шара мощных залежей NaCl, который и служит основным исходным сырьем для полученияхлора.
Общее мировое потребление хлора (без СССР) составляет около 10 млн. т ежегодно. Используется он главным образом для беления тканей и бумажной массы, обеззараживания питьевой воды (примерно 1,5 г на 1 м3) и в химической промышленности.
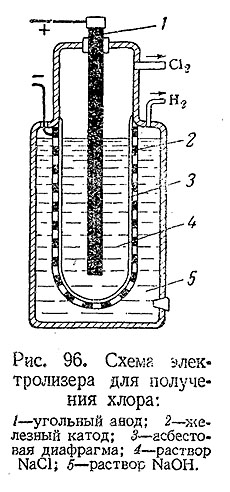
Основным промышленным методом получения хлора является электролиз концентрированногораствора NaCl (рис. 96). При этом на аноде выделяется хлор (2Сl’ – 2e– = Сl2 ), а в катодном пространстве выделяется водород (2Н· + 2e– = H2 ) и образует NaOH.
При лабораторном получении хлора обычно пользуются действием МnО2 или КМnО4 насоляную кислоту:
МnО2 + 4НСl = МnСl2 + Cl2 + 2Н2 О
2КМnО4 + 16НСl = 2КСl + 2МnСl2 + 5Сl2 + 8Н2 О
Вторая реакция протекает значительно энергичнее первой (требующей подогревания).
Свободный хлор представляет собой желто-зеленый газ (т. пл. -101 °С, т. кип. -34°С), состоящий из двухатомных молекул. Один объемводы растворяет около двух объемов хлора. Образующийся раствор часто называют «хлорной водой».
Хлор обладает резким запахом и вызывает воспаление дыхательных путей, В качестве средства первой помощи при острых отравлениях им применяется вдыхание паров смеси спирта с эфиром. Полезно также вдыхание паров нашатырного спирта.
По своей характерной химической функции хлор подобен фтору — он также является активным одновалентным металлоидом. Однакоактивность его меньше, чем у фтора. Поэтому последний способен вытеснять хлор из соединений.
Тем не менее химическая активность хлора очень велика - он непосредственно соединяется почти со всеми обычными металлами(иногда лишь в присутствии следов воды или при нагревании) и со всеми металлоидными элементами, кроме углерода, азота и кисло рода. Важно отметить, что при отсутствии влаги хлор практически не действует на железо.
1) Взаимодействие хлора с фтором происходит лишь при нагревании их смеси выше 200 °С. В этих условиях образуется бесцветный ClF (т. пл. -154 °C,т. кип. -101 °С), а нагреванием его с избытком фтора может быть получен бесцветный ClF3 . Оба веществахарактеризуются своей исключительно высокой реакционной способностью.
Взаимодействие хлора с водородом по реакции Н2 + Cl2 = 2HCl + 44 ккалпри обычных условиях протекает крайне медленно, но при нагревании смеси газов или ее сильном освещении (прямым солнечным светом, горящим магнием и т. д.) реакция сопровождается взрывом.
Детальное изучение этой реакции позволило выяснить характер протекания ее отдельных стадий (т. н. элементарных процессов). Прежде всего, за счет энергии ультрафиолетовых лучей (или нагревания) молекула хлора диссоциирует на атомы, которые затем реагируют с молекулами водорода, образуя НСl и атом водорода. Последний, в свою очередь, реагирует с молекулой хлора, образуя НСl и атом хлора, и т. д. Весь процесс может быть изображен следующей схемой:
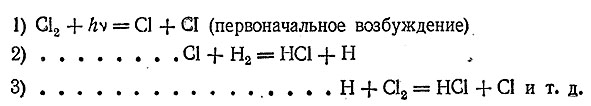
Таким образом получается как бы цепь последовательных реакций, причем за счет каждой первоначально возбужденной молекулы Сl2образуется до миллиона молекул НСl. Реакции подобного типа называются цепными. Они играют большую роль при протекании многих химических процессов.
В настоящее время прямой синтез является основным промышленным методом получения НСl. Исходным сырьем служат хлор иводород, одновременно выделяющиеся при электролизе раствора NaCl. Спокойное протекание процесса обеспечивают смешиванием обоих газов лишь в момент взаимодействия.
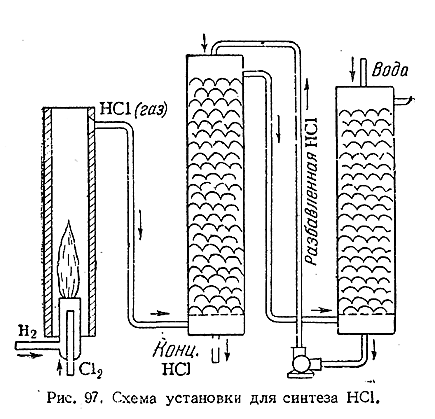
2) Для технического синтеза НСl служит установка, схематически показанная на рис. 97. После первоначального поджигания смесьхлора с водородом продолжает гореть спокойным пламенем, образуя хлористый водород. Последний проходит затем через две поглотительные башни, в которых и поглощается водой. Используемый в системе принцип противотока, т. е. противоположных направлений движения газа и жидкости, обеспечивает полноту поглощения НСl и позволяет проводить весь процесс непрерывно.
Другой метод технического получения НСl основан на взаимодействии NaCl и концентрированной H2 SO4 по реакциям:
NaCl + H2 SO4 = NaHSO4 + HCl
NaCl + NaHSO4 = Na2 SO4 + HCl
Первая из них отчасти протекает уже при обычных условиях и практически нацело – при слабом нагревании; вторая осуществляется лишь при более высоких температурах. Для проведения процесса служат механические печи большой производительности.
Хлористый водород представляет собой бесцветный газ (т. пл. –112°С, т. кип. –84 °С). В отсутствие влаги при обычных температурах он не действует на большинство металлов и их окислов. Газообразный кислород окисляет его только при нагревании.
На воздухе хлористый водород дымит вследствие образования с парами воды капелек тумана. Растворимость его весьма велика: при обычных условиях 1 объем воды способен поглотить до 450 объемов хлористого водорода.
Раствор НСl в воде называется хлористоводородной (иначе – соляной) кислотой. Последняя относится к числу наиболее сильныхкислот. Концентрированная соляная кислота имеет плотность 1,19 и содержит около 37% хлористого водорода.
Подобно другим сильным кислотам, НСl энергично растворяетмногие металлы. Большинство ее солей – хлористых, илихлоридов, – хорошо растворимо в воде. Из производных обычных металлов труднорастворимы лишь хлориды серебра исвинца.
Ежегодное мировое потребление соляной кислоты исчисляется миллионами тонн. Широкое практическое применение находят также многие ее соли.
Так как с кислородом хлор не взаимодействует, его кислородные соединения могут быть получены лишь косвенными методами. При рассмотрении путей их образования целесообразно исходить из обратимой реакции между хлором и водой
Сl2 + Н2 О = НСl + НОСl
При обычных условиях в насыщенном растворе гидролизовано около половины всего растворенного хлора.
Из образующихся при гидролизе хлора двух кислот – соляной и хлорноватистой (НОСl) –первая является очень сильной, а вторая – очень слабой (К = 3 ·10–8). Это резкое различие в силе обеих кислот можно использовать для их разделения.
Если в воде взболтать порошок мела (СаСОз) и затем пропускать в нее хлор, то соляная кислота реагирует с мелом (по уравнению СаСО3 + 2НСl = СаСl2 + СО2 + Н2 О), а хлорноватистая накапливается в растворе. Подвергая реакционную смесь перегонке, получают в приемнике разбавленный раствор НОСl.
Будучи соединением неустойчивым, НОСl медленно разлагается даже в таком разбавленном растворе. Соли хлорноватистой кислотыназываются хлорноватистокислыми, или гипохлоритами. Сама НОСl и ее соли являются очень сильными окислителями.
Метод получения гипохлоритов основан на использовании приводившейся выше обратимой реакции взаимодействия хлора с водой. Так как оба вещества правой части равенства НСl и НОСl – дают в растворе ионы Н+, а оба исходных продукта – Сl2 и Н2 О – таких ионовпрактически не образуют, равновесие можно сместить вправо, связывая ионы Н+.
Добиться этого проще всего добавлением к реакционной смеси щелочи. Так как по мере образования ионы Н будут связываться ионамиОН' в недиссоциированные молекулы воды, равновесие сместится вправо. Применяя, например, NaOH имеем:
Сl2 + Н2 О <–––> НОСl + НСl
HOCl + НСl + 2NaOH –––>NaOCl + NaCl + 2H2 O
или в общем:
Сl2 + 2NaOH –––>NaOCl + NaCl + Н2 О
В результате взаимодействия хлора с раствором щелочи получается, следовательно, смесь солей хлорноватистой и соляной кислот. Образующийся раствор («жавелевая вода») обладает сильными окислительными свойствами и широко применяется для отбелкитканей и бумаги.
При взаимодействии хлора с более дешевой щелочью – Са(ОН)2 – образуется так называемая хлорная известь. Реакция может быть приближенно выражена уравнением
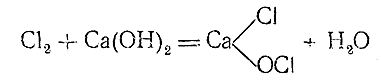
согласно которому хлорная известь является смешанной солью соляной и хлорноватистой кислот.
Хлорная (иначе, белильная) известь представляет собой белый порошок, обладающий сильными окислительными свойствами. Она применяется для беления и дезинфекции, а также служит одним из основных дегазаторов, т. е. средств для уничтожения боевыхотравляющих веществ var container = document.getElementById('nativeroll_video_cont'); if (container) { var parent = container.parentElement; if (parent) { const wrapper = document.createElement('div'); wrapper.classList.add('js-teasers-wrapper'); parent.insertBefore(wrapper, container.nextSibling); } }





























