Из элементов данной подгруппы № 43 – технеций (Тс) – в земной коре не содержится. Очень малые его количества были получены искусственно, причем установлено, что по химическим свойствам он в общем гораздо ближе к рению, чем к марганцу. Однако детальное изучение самого элемента и его соединений пока не осуществлено.
Марганец принадлежит к распространенным элементам, составляя 0,03% от общего числаатомов земной коры. Небольшие количества Мn содержат многие горные породы. Вместе с тем встречаются и скопления его кислородных соединений, главным образом в виде минералапиролюзита – МnО2 ·xН2 О. Ежегодная мировая добыча марганцовых руд составляет около 5 млн. т.
Чистый марганец может быть получен электролизом растворов его солей. Однако 90% всей добычи Мn потребляется при изготовлении различных сплавов на основе железа. Поэтому изруд обычно выплавляют прямо его высокопроцентный сплав с железом – ферромарганец (60–90% Мn), которым затем и пользуются для введения марганца в другие сплавы. Выплавку ферромарганца из смеси марганцовых и железных руд ведут в электрических печах, прячеммарганец восстанавливается углеродом по реакции:
МnО2 + 2С + 70 ккал = 2СО + Мn
Содержание рения в земной коре весьма мало (9 ·10–9 %). Элемент этот является чрезвычайно распыленным: даже наиболее богатые рением минералы (молибдениты) содержат его в количествах, обычно не превышающих 0,002% по весу. Сколько–нибудь широкого использования рений и его производные пока не находят.
1) Для получения металлического рения обычно пользуются нагреванием перрената аммония в токе водорода:
2NH4 ReO4 +4H2 = 8H2 O + N2 + 2Re
Ежегодная мировая выработка рения и его производных исчисляется сотнями килограммов.
В виде порошков марганец и рений представляют собой серые, в компактном состоянии – белые металлы, похожие по внешнему виду на железо (Мn) или платину (Re). Важнейшие их константы сопоставлены ниже:

Механические свойства обоих металлов сильно зависят от способа их выделения и предварительной обработки.
2) Электропроводность рения приблизительно в 4 раза меньше, чем вольфрама. Металл этот представляет собой прекрасный материал для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые.
На воздухе компактный металлический марганец покрывается тончайшей пленкой окисла, которая предохраняет его от дальнейшегоокисления даже при нагревании. Напротив, в мелко раздробленном состоянии он окисляется довольно легко. Взаимодействие его сгалоидами протекает весьма энергично и ведет к образованию солей МnГ2 . При нагревании марганец соединяется также с другими типичными металлоидами – серой, азотом, фосфором, углеродом, кремнием и бором. С водородом он не реагирует.
Химическая активность рения несколько ниже. Так, он взаимодействует при нагревании с кислородом, серой и галоидами, но с азотомнепосредственно не соединяется. Водород довольно сильно поглощается порошком рения, однако каких–либо химических соединенийпри этом не образуется.
В ряду напряжений марганец стоит между Mg и Zn. В соответствии с этим порошок его при нагревании разлагает воду, С разбавленными кислотами марганец реагирует весьма энергично, вытесняя водород по реакции, например:
Mn + H2 SO4 = >MnSO4 + H2
Рений располагается в ряду напряжений несколько правее меди и с разбавленными НСl и H2 SO4 не взаимодействует. Азотная кислотареагирует с ним по уравнению:
3Re + 7HNO3 = >3HReO4 + 7NO + 2Н2 О
Положение технеция в ряду напряжений пока не установлено. Известно, однако, что он вытесняется из растворов его солей цинком и может быть осажден на катоде при помощи, электролиза.
Марганец весьма интересен в химическом отношении, так как образует соединения, на которых может быть прослежено влияние изменения валентности элемента на свойства. Хорошо изучены его производные, отвечающие следующим окислам:
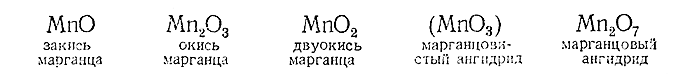
Так как повышение положительной валентности атома связано с увеличением его заряда и уменьшением радиуса, можно ожидать (в соответствии с рис. 87) что диссоциация марганцовых соединений типа ЭОН будет при разных валентных состояниях марганцапротекать различно. Как показывает приводимая ниже схема, это и имеет место в действительности:
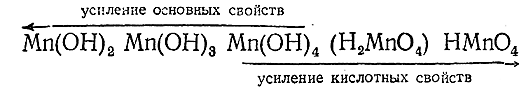
Аналогичное изменение свойств наблюдается у производных рения. И для Re и для Тс наиболее характерно семивалентное состояние.
Обычным исходным продуктом для получения соединений марганца служит природный пиролюзит. Нагреванием его в струе водородаможет быть получен зеленый, нерастворимый в воде, но легко растворяющийся в кислотах порошок закиси марганца (МnО). Отвечающие этому окислу соли образуются также при растворении в кислотах самого пиролюзита, например, по реакциям:
МnО2 + 4НСl = МnСl2 + Сl2 + 2Н2 О
2MnO2 + 2H2 SO4 = 2MnSO4 + O2 + 2H2 O





























